4.1.1. Основні білки м’язової тканини
Міоген складається із комплексу міогенів А, В і С. Міоген становить близько 20 % від усіх білкових волокон і є повноцінним білком. Він розчиняється у воді, утворюючи 20 — 30%-ві гомогенні розчини з невеликою в’язкістю. Температура денатурації вільного від солей міогену 55 — 60 °С, ізоелектрична точка в інтервалі рН 6,0 — 6,5. З часом частина міогену переходить у нерозчинний стан.
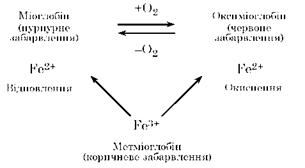
Міоглобін. Вміст міоглобіну в м’язовій тканині становить близько 1 % і залежить від віку тварин і виду м’язів. Це розчинний у воді білок. Міоглобін — пігмент хромопротеїд, який складається із глобіну і гему (феропротопорфірин), що координаційно пов’язані між собою. Глобін, що входить до складу протеїду, за амінокислотним складом є повноцінним білком. На одну молекулу міоглобіну припадає один гем. Температура денатурації міоглобіну близько 60 °С. Денатурація міоглобіну супроводжується відщепленням простетичної групи. Міоглобін здатен приєднувати оксид азоту, сірководень та кисень за рахунок додаткових зв’язків. У разі приєднання кисню утворюється оксиміоглобін, який з часом переходить у метміоглобін буро-коричневого кольору. При цьому залізо віддає один електрон. Під дією відновників метміоглобін знову відновлюється до міоглобіну.
Міоглобін забарвлений у темно-червоний колір і зумовлює природне забарвлення м’язової тканини. Інтенсивність забарвлення м’яса залежить від вмісту міоглобіну. При переході міоглобіну в метміоглобін забарвлення м’яса стає коричневим, воно помітне, коли змінюється близько 50 % міоглобіну за схемою:
|
|
Міоглобін крім передавача кисню виконує також роль міцного фактора, що полегшує проникнення кисню в середину клітин. Унаслідок цього у м’язах, що працюють інтенсивно, вміщується відносно більше міоглобіну, тому вони мають темніше забарвлення (наприклад, м’язи ніг і шиї великої рогатої худоби, м’язи коней), ніж м’язи, що не працюють або працюють менш інтенсивно.
Глобулін Х — білок, що становить близько 20 % від усієї кількості білкових речовин м’язової клітини. Він є повноцінним, не розчиняється у воді, але розчиняється в сольових розчинах навіть низької концентрації. Температура денатурації при рН 6,5 близько 50 °С, при рН 7,0 — 80 °С, ізоелектрична точка лежить близько рН 5,2. Глобуліну Х притаманні ферментативні властивості.
Міоальбуміни складають близько 1 — 2 % білкових речовин м’язового волокна. Вони розчиняються у воді і не розчиняються в кислому середовищі, оскільки мають ізоелектричну точку близько рН 3 - 3,5, температура їх денатурації 45 - 47 °С.
Нуклеопротеїди. До складу білків саркоплазми нуклеопро- теїди входять у невеликій кількості. Вони зосереджені переважно в рибосомах, саркоплазматичному ретикулі. Особливістю їх є наявність у структурі молекули рибози, тобто нуклеїнові кислоти нуклеопротеїдів саркоплазми є рибонуклеїновими кислотами (РНК).
Установлено, що білки саркоплазми мають желеутворювальну здатність, особливо за наявності аденозинтрифосфорної кислоти (АТФ). За високих концентрацій Са++ гель розріджується. Желе- утворення білків саркоплазми залежить від наявності в середовищі фрагментів саркоплазматичного ретикулума. Видалення цих фрагментів не дає білкам можливості утворювати гель, що пов’язано з властивостями ретикулума, з його роллю в переміщенні Са.
Білки міофібрил. Міозин — повноцінний фібрилярний білок, що становить близько 40 % білкових волокон, добре перетравлюється. Його молекули мають виражену ферментативну активність, легко взаємодіють між собою і актином, мають високу водо- зв’язувальну, гелеутворювальну і емульгуючу здатності.
Здатність зв’язувати катіони металів та деякі інші фізико- хімічні властивості міозину пояснюються особливостями складу його первинної структури і будовою молекул. Близько 30 % усього амінокислотного складу міозину припадає на частку дикарбоно- вих кислот (глютамінової і аспарагінової), що надає білку кислотного характеру і зумовлює специфічну здатність зв’язувати йони калію, кальцію і магнію за рахунок великої кількості вільних карбоксильних груп. Тому ізоелектрична точка міозину лежить у кислій зоні при рН 5,4 — 5,5.
Здатність міозину з’єднуватися з актином та його АТФ-актив- ність залежать від наявності в молекулі білка вільних сульфгідрильних груп.
Міозин має ферментативну активність, каталізує гідролітичний розпад аденозинтрифосфорної кислоти на аденозиндифос- форну і фосфорну кислоти:
![]()
Розпад АТФ під впливом міозину супроводжується відокремленням неорганічного фосфату та виділенням з високоенергетичного зв’язку нуклеотиду великої кількості енергії, яка використовується для здійснення акту м’язового скорочення. Аденозинтри- фосфатазна активність міозину залежить від наявності в складі молекули вільних ЯН-груп і деяких солей (кальцію, магнію) та рН середовища. Молекули міозину легко асоціюють одна з одною, утворюючи часточки з молекулярною масою, яка приблизно в 8 разів більша за вихідну. Крім того, міозин взаємодіє з іншими білками і компонентами клітин, наприклад міозин утворює міцний комплекс з актином і глікогеном.
У клітинах міозин здатний бути у комплексі з ліпідами (в складі цієї фракції є холестерин). Міозин денатурує за температури 45 - 50 °С.
Актин становить 12 — 15 % від усіх м’язових білків. Він є основним компонентом тонких ниток у структурі міофібрил м’язового волокна. Актин — повноцінний білок, що добре перетравлюється харчовими ферментами.
Актин може існувати в двох формах, різних за фізико- хімічними властивостями: Г-актин (молекули кулеподібні) і фіб- рилярний Ф-актин (молекули витягнуті).
У волокнах живих м’язів у стані спокою актин перебуває в глобулярній і фібрилярній формах. Фібрилярний актин може переходити у глобулярний і навпаки.
Так, під впливом розчинних солей лужних і лужноземельних металів у певних концентраціях актин переходить у фібрилярну форму в результаті лінійної агрегації молекул. При видаленні цих солей він знову перетворюється на глобулярний актин. Фібрилярний актин утворюється також при заморожуванні м’язів, унаслідок підвищення концентрації в них солей.
Актоміозин — комплексний білок. Він складається з двох білків актину і міозину. За певних умов міозин ЯН-групами здатний взаємодіяти з оксигрупами фібрилярного актину, утворюючи актоміозин. Співвідношення актину і міозину в м’язах 1 : 3. Актоміозин має інші властивості, ніж актин і міозин. Скорочуючись, він зумовлює скорочення м’язів за життя тварин та при посмертному задубінні. Істотну роль у цьому процесі відіграє АТФ. За наявності аденозинтрифосфорної кислоти і залежно від її концентрації актоміозин частково або повністю дисоціює на актин та міозин. У складі м’язової тканини актоміозин залежно від умов може перебувати в асоційованій або частково дисоційованій формі, що вміщує незначну кількість актину. Дисоціація актоміозину на вихідні компоненти відбувається при підвищеній концентрації солі. При розведенні актоміозин випадає в осад. Температура денатурації актоміозину 42 - 48 °С. Актоміозин не розчиняється у воді.
Тропоміозин — структурний білок міофібрил. Він становить
4 — 7 % міофібрилярних білків. За амінокислотним складом тропоміозин відрізняється від міозину: в його молекулі немає триптофану. Водночас він має високий вміст дикарбонових і основних амінокислот. Характерною особливістю білка є стійкість до денатурації. В 0,1 М сольовому розчині тропоміозин не осаджується при нагріванні до 100 °С при рН 6,3. Тропоміозин міститься в міофібрилах, в яких він зосереджений в ізоторопних дисках в зоні ^-мембран. Тропоміозин є складним комплексом з двох білків: тропоміозину Б і тропіну. Перший збільшує чутливість актоміозину до Са2+ й ініціює АТФ-активність міозину.
У процесі скорочення м’язів тропоміозин виконує функцію, пов’язану з передачею кальцію.
Крім перелічених білків у міофібрилах вміщуються інші білки (водорозчинні), функції яких ще до кінця не виявлені. Серед них можна виділити а-актинін, який сильно активує взаємодію Ф-ак- тину з тропоміозином. Інший білок, виділений з міофібрил (Р-ак- тинін), оточує нитки Ф-актину в дисках. Десмін-білок бере участь у побудові .£-ліній міофібрил.
Білки строми. До цієї групи належать білки, що складають сарколему і пухку сполучну тканину, які об’єднують м’язові волоконця в м’язові пучки. На поверхні сарколеми розташовані сполучнотканинні волокна, що складаються з білків сполучної тканини (протеїноїдів): колагену, еластину і ретикуліну. У міжклітинному просторі м’язової тканини містяться муцини і мукоїди — слизопо- дібні білки, що виконують захисні функції і полегшують ковзання м’язових пучків.